Це переклад статті “Whole-body endothermy in a mesopelagic fish, the opah, Lampris guttatus” , написаної Nicholas C. Wegner, Owyn E. Snodgrass , Heidi Dewar, John R. Hyde

Здатність організму зберігати метаболічне тепло та підтримувати температуру тіла вище за навколишнє середовище (ендотермія) збільшує швидкість реакцій, потужність м'язів та здатність до тривалих аеробних навантажень. Цей процес надає явні переваги, особливо для організмів, що мешкають у середовищах з низькою або змінною температурою (1, 2). Таким чином, ендотермічні організми демонструють вищу здатність до розширення екологічної ніші та часто отримують конкурентну перевагу над організмами, які термоконформуються до свого середовища (наприклад, у взаємодіях хижак-жертва) (2-5). Через високу теплоємність води, утримання тепла в тілі в водних середовищах є надзвичайно складним завданням, навіть для ссавців, і тому лише невелика кількість високоактивних видів риб (<0,1% описаних риб) набули здатність утримувати деяку кількість внутрішньо виробленого тепла (6-9). Ці риби називаються "регіональними ендотермами", оскільки, на відміну від ссавців і птахів, вони здатні підвищувати температуру лише певних тканин або органів.
Регіонально ендотермічні тунці (родина Scombridae) та оселедцеві акули (родина Lamnidae) (які нагрівають внутрішні червоні аеробні м'язи, що використовуються для безперервного плавання) (6-12) і риби-мечі (родини Istiophoridae та Xiphiidae, які нагрівають лише область очей та мозку) (13, 14) часто називаються "високопродуктивними" рибами через їх підвищену фізіологічну функцію, пов'язану з регіональним утриманням тепла (8, 15). Проте ці риби значно поступаються повній ендотермії всього тіла, оскільки велика частина їхнього тіла (включаючи життєвоважливі органи, такі як серце) залишається при температурі навколишнього середовища, що в кінцевому підсумку обмежує аеробні можливості в холодній воді (16, 17). Це обмеження пов'язане з механізмами, які використовуються цими групами для зменшення втрат тепла. Хоча теплопровідна втрата тепла у воду мінімізується завдяки розташуванню тепловиробних тканин поблизу середньої лінії тіла та ізоляції від навколишніх тканин, основним викликом для ендотермії риб є конвективна втрата тепла, коли кров тісно контактує з водою в зябрових пластинках (місце обміну респіраторними газами). Для зменшення конвективної втрати тепла ці риби мають retia mirabilia або "дивовижні сітки" кровоносних судин, які формують протиточні теплообмінники, що складаються з густо упакованих артеріол та венул, що течуть у протилежних напрямках, де тепла венозна кров, що повертається від місця тепловиробництва, передає своє тепло холодній артеріальній крові, що надходить від зябер (18). На сьогодні ці retia у риб були виявлені лише у зв'язку з певними групами м'язів або органами, залишаючи серце та багато інших тканин при температурі навколишньої води.
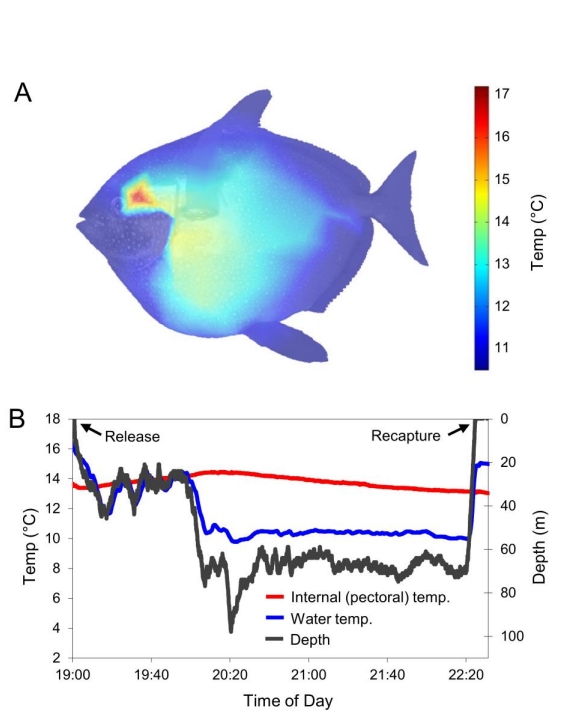
Це дослідження представляє морфологічні, температурні та поведінкові дані, які демонструють незалежну еволюцію більш цілісної форми ендотермії, присутньої у риби опах, Lampris guttatus, погано вивченої великої мезопелагічної риби, поширеної в обох півкулях. Показано, що, на відміну від інших риб, опах має ймовірні структури збереження тепла, розташовані всередині зябер, що ізолює основне місце втрати тепла від решти тіла. Вимірювання температури in situ, отримані для свіжозабитих опахів, виловлених під час рибогосподарських обстежень, показують, що все ядро тіла (грудна плавальна мускулатура, вісцеральні органи та серце) і черепна область (Таблиця 1) значно тепліші за навколишнє середовище. Представлений накладений тепловий профіль для опаха вагою 40,0 кг, реконструйований з понад 35 вимірювань температури, зроблених на глибині 4-5 см під шкірою по всьому тілу (Рисунок 1А), показує загальний розподіл підвищених температур. Підвищені температури in situ були підтверджені вимірюваннями in vivo, зробленими у плаваючих опахів, випущених з нашого риболовного судна з термопарою, розміщеною в грудній мускулатурі та прикріпленою до поверхневого поплавця для повторного вилову. Ці риби мали середню температуру грудних м'язів, вищу на 4,8 ± 1,2 °C вище за навколишню (Таблиця 1), коли плавали на глибинах від 50 до 300 м при температурі води 7,8-10,8 °C (дані для опаха вагою 39,0 кг показані на Рис. 1B).
У риби опах основна частина метаболічного тепла, здається, виробляється темно-червоною аеробною грудною мускулатурою, яка використовується під час безперервного плавання (19) і ізольована від води шаром жирової сполучної тканини товщиною 0,88 ± 0,21 см (середня товщина ± стандартне відхилення для 16 опахів, вагою 22,0-67,5 кг, Рис. S1). На відміну від більшості риб, які використовують хвилеподібні рухи тіла для досягнення поступального руху під час плавання, опах в основному використовує осциляцію грудних плавців (Фільм S1). Аеробна грудна мускулатура у опаха складає 16% від їхньої загальної маси (37% від загальної грудної мускулатури) (19), що є одним з найвищих показників, зареєстрованих для будь-якої риби, і на 25-800% більше, ніж у регіонально ендотермічних тунців та оселедцевих акул, які нагрівають свою аеробну міотомну плавальну мускулатуру (Таблиця S1).
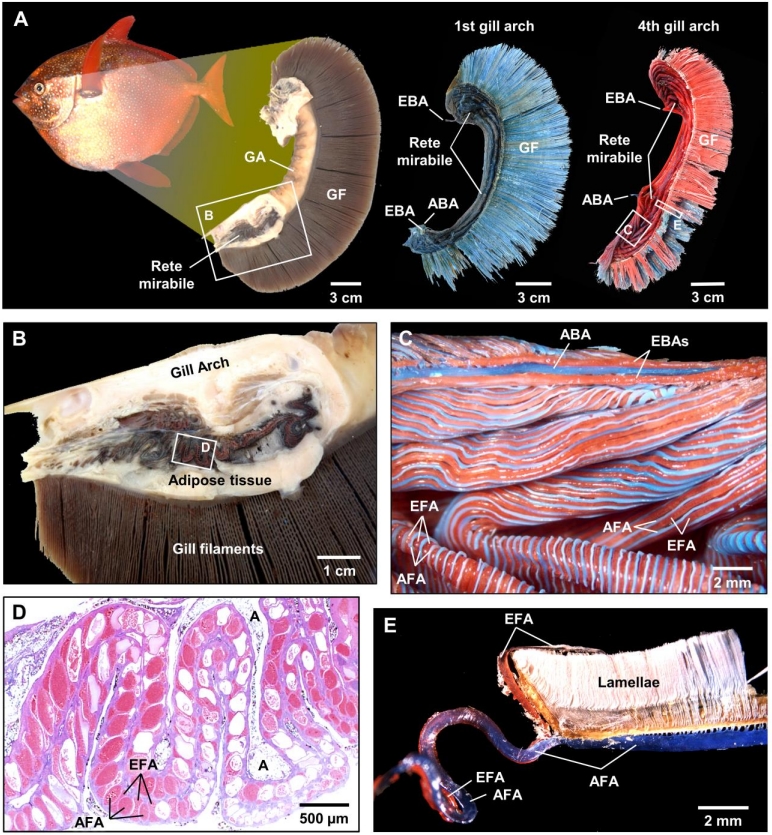
Винятковістю риби опах є розташування протиточних retia mirabilia всередині кожної товстої, ізольованої жиром зябрової дуги (Рис. 2), що термічно ізолює поверхні респіраторного обміну від решти тіла. Судинні зліпки зябер (Рис. 2A, C, E) показують, що, на відміну від інших риб, розширення афферентних та ефферентних філаментних артерій (які постачають і збирають кров безпосередньо до і після газообміну в зябрових ламелях) вбудовані в кожну зяброву дугу в щільно згрупований і звивистій спосіб, утворюючи артеріо-артеріальне rete. Зокрема, афферентні та ефферентні артерії кожного окремого філамента тісно пов'язані (Рис. 2E) і розташовані по черзі всередині дуги (Рис. 2C, D), так що холодна насичена киснем кров кожної ефферентної судини (що повертається з поверхонь респіраторного обміну) повинна нагріватися шляхом проведення тепла від теплої бідної на кисень крові в афферентних філаментних артеріях з обох боків (які несуть кров до поверхонь газообміну). Як результат, насичена киснем кров, що залишає поверхні респіраторного обміну, повинна нагріватися перед входом в ефферентні зяброві артерії для розподілу до решти тіла.
Хоча ці артеріо-артеріальні rete повинні циркулювати теплу кров по всьому тілу, черепна область є теплішою, ніж ядро тіла (Таблиця 1, Рис. 1), що вказує на додаткове джерело тепла, пов'язане з мозком і екстраокулярними м'язами (м'язами, що рухають око під час плавання). Попередні дослідження припускають, що тепло може вироблятися проксимальною областю парних латеральних прямих м'язів, які кріпляться до основи черепа (безпосередньо вентрально до мозку) і зберігатися за допомогою малих rete, пов'язаних з латеральними і верхніми прямими м'язами (20).
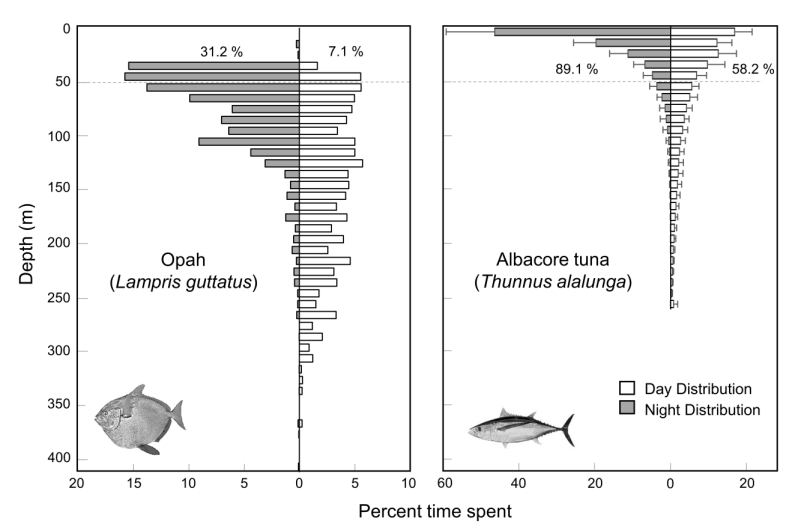
Особливо важливим є здатність риби опах підвищувати температуру серця, яке отримує теплу кров як від коронарних артерій, так і від системного венозного повернення і ізольоване від операкулярних порожнин шаром жиру товщиною 0,56 ± 0,07 см (середня товщина від 15 опахів вагою 22,0-67,5 кг). Для регіонально ендотермічних тунців та оселедцевих акул (які не можуть нагрівати серце) як аеробна продуктивність, так і занурення для харчування в холодну воду вважаються значною мірою обмеженими функцією серця, з ослабленим збудженням–скороченням (E-C) серця, що призводить до зниження серцевих викидів при нижчих температурах (16, 17, 21, 22), що, ймовірно, змушує більшість видів повертатися до поверхневих вод, щоб зігрітися між глибокими зануреннями в холодну воду. Хоча деякі регіонально ендотермічні види, такі як Оселедцева акула, Lamna ditropis, які проводять значний час у холодних водах, демонструють підвищену експресію E-C білків для допомоги в пом'якшенні ефекту низьких температур, функція серця все ж значно знижується при холодних температурах (22). Докази широкої термічної толерантності у риби опах походять з даних супутникового відстеження, які показують, що опах проводить більшу частину свого часу нижче змішаного поверхневого шару на глибинах між 50 і 400 м (23, Рис. 3) без регулярних відвідувань поверхневих вод для зігрівання.
З теплим ядром тіла, серцем і ще теплішою черепною областю, риба опах має здатність до підвищеної фізіологічної функції у своєму глибоководному холодному середовищі. Підвищена температура тіла опаха повинна збільшувати потужність м'язів і здатність до тривалих навантажень, покращувати нейронну провідність для очей і мозку, підвищувати швидкість травлення і асиміляції їжі в травному тракті та зменшувати вплив холодних температур навколишнього середовища на роботу серця та інших органів. Підтверджуючи свою ендотермічну здатність і підвищену аеробну продуктивність, опах має відносно велике серце і поверхню зябер, високий рівень гематокриту та незвично велику масу аеробних м'язів (Таблиця S1), що є схожим з характеристиками високопродуктивних хижаків, таких як тунці, і різко контрастує з іншими рибами з його ряду (ряд Lampridiformes), які, як правило, є повільними хижаками-засідниками.
У багатьох аспектах опах конвергував з регіонально ендотермічними рибами, такими як тунці та оселедцеві акули, для підвищення аеробної здатності. Однак, на відміну від цих активних, більш поверхнево орієнтованих хижаків, які, як вважається, походять від тропічних предків і використовують регіональну ендотермію для розширення своєї термічної толерантності або використання середовища проживання в глибокі та холодніші води (6, 7), еволюційна історія опаха, ймовірно, пов'язана з більшими океанічними глибинами, причому всі, крім найбільш базальної лінії Lampridiformes, мешкають у мезопелагічній зоні (200-1000 м глибини) (24). Тому, замість використання регіональної ендотермії для занурення нижче термоклину під час тимчасових харчових занурень, опах (зі своєю більш цілісною формою ендотермії) особливо спеціалізований для життя в холодних глибинних водах, зберігаючи підвищені рівні фізіологічної продуктивності. Відкриття цієї форми ендотермії, разом з нещодавнім виявленням кількох різних видів опаха, що мешкають у різних регіонах океанів світу (25) (включаючи субполярного південного опаха, Lampris immaculatus), створює основу для майбутніх порівняльних досліджень, щоб далі вивчати цю ключову еволюційну інновацію.
Таблиця 1. Регіональні вимірювання температури тіла (середні значення ± стандартне відхилення), зроблені у свіжовиловлених та вільно плаваючих опахів
Частина тіла | Середня темп.(°C) | Різниця температури над навколишнім середовищем (°C) | К-сть риб |
|---|---|---|---|
Pectoral muscle( in situ) | 13.8 ± 1.5 | 3.8 ± 0.8 | 22 |
Cranial region( in situ) | 16.1 ± 3.9 | 6.0 ± 3.0 | 22 |
Viscera( in situ) | 13.5 ± 1.6 | 3.5 ± 1.0 | 21 |
Heart( in situ) | 13.2 ± 1.7 | 3.2 ± 0.7 | 19 |
Pectoral muscle( in vivo) | 14.4 ± 0.4 | 4.8 ± 1.2 | 4 |
Посилання:
1. A. F. Bennett, Thermal dependence of muscle function. Amer. J. Physiol. 247, R217-229 (1984).
2. B. K. McNab, The Physiological Ecology of Vertebrates: A View from Energetics. (Comstock, Ithaca, NY, 2002).
3. A. F. Bennett, J. A. Ruben, Endothermy and activity in vertebrates. Science 206, 649-654 (1979).
4. W. J. Hillenius, J. A. Ruben, The evolution of endothermy in terrestrial vertebrates: Who? When? Why? Physiol. Biochem. Zool. 77, 1019-1042 (2004).
5. J. Ruben, The evolution of endothermy in mammals and birds: From physiology to fossils. Ann. Rev. Physiol. 57, 69-95 (1995).
6. K. A. Dickson, J. B. Graham, Evolution and consequences of endothermy in fishes. Physiol. Biochem. Zool. 77, 998-1018 (2004).
7. B. A. Block, J. R. Finnerty, A. F. R. Stewart, J. Kidd, Evolution of endothermy in fish: Mapping physiological traits on a molecular phylogeny. Science 260, 210-214 (1993).
8. D. Bernal, K. A. Dickson, R. E. Shadwick, J. B. Graham, Review: Analysis of the evolutionary convergence for high performance swimming in lamnid sharks and tunas. Comp. Biochem. Physiol. 129A, 695-726 (2001).
9. F. G. Carey, J. M. Teal, J. W. Kanwisher, K. D. Lawson, J. S. Beckett, Warm-bodied fish. Amer. Zool. 11, 137-145 (1971).
10. D. Bernal, J. M. Donley, R. E. Shadwick, D. A. Syme, Mammal-like muscles power swimming in a cold-water shark. Nature 437, 1349-1352 (2005).
11. J. M. Donley, C. A. Sepulveda, P. Konstantinidis, S. Gemballa, R. E. Shadwick, More than skin deep: Convergent evolution in mechanical design of lamnid sharks and tunas. Nature 429, 61-65 (2004).
12. J. B. Graham, K. A. Dickson, in Tuna: Physiology, Ecology and Evolution, B. A. Block, E. D. Stevens, Eds. (Academic Press, San Diego, 2001), vol. 19, pp. 121-165.
13. B. A. Block, Structure of the brain and eye heater tissue in marlins, sailfish, and spearfishes. J. Morphol. 190, 169-189 (1986).
14. F. G. Carey, A brain heater in the swordfish. Science 216, 1327-1329 (1982).
15. R. W. Brill, Selective advantages conferred by the high performance physiology of tunas, billfishes, and dolphin fish. Comp. Biochem. Physiol. 113A, 3-15 (1996).
16. H. A. Shiels, A. D. Maio, S. Thompson, B. A. Block, Warm fish with cold hearts: thermal plasticity of excitation-contraction coupling in bluefin tuna. Proc. R. Soc. B 278, 18-27 (2011).
17. P. C. Castilho, A. M. Landeira-Fernandez, J. Morrissette, B. A. Block, Elevated Ca2+ ATPase (SERCA2) activity in tuna hearts: Comparative aspects of temperature dependence. Comp. Biochem. Physiol. 148A, 124-132 (2007).
18. E. D. Stevens, in Encyclopedia of Fish Physiology: From Genome to Environment, A. P. Farrell, E. D. Stevens, J. J. Cech, J. G. Richards, Eds. (Academic Press, San Diego, 2011), vol. 2, pp. 1119-1131.
19. R. H. Rosenblatt, G. D. Johnson, Anatomical considerations of pectoral swimming in the opah, Lampris guttatus. Copeia 1976, 367-370 (1976).
20. R. M. Runcie, H. Dewar, D. R. Hawn, L. R. Frank, K. A. Dickson, Evidence for cranial endothermy in the opah (Lampris guttatus). J. Exp. Biol. 212, 461-470 (2009).
21. J. M. Blank et al., In situ cardiac performance of Pacific bluefin tuna hearts in response to acute temperature change. J. Exp. Biol. 207, 881-890 (2004).
22. K. C. Weng et al., Satellite tagging and cardiac physiology reveal niche expansion in salmon sharks. Science 310, 104-106 (2005).
23. J. J. Polovina, D. Hawn, M. Abecassis, Vertical movement and habitat of opah (Lampris guttatus) in the central North Pacific recorded with pop-up archival tags. Mar. Biol. 153, 257–267 (2008).
24. J. E. Olney, in Species identification guide for fisheries purposes. Part 1 (Elopidae to Linophrynidae), K. E. Carpenter, V. H. Niem, Eds. (FAO, Rome, 1999).
25. J. R. Hyde, K. E. Underkoffler, M. A. Sundberg, DNA barcoding provides support for a cryptic species complex within the globally distributed and fishery important opah (Lampris guttatus). Mol. Ecol. Resour. 14, 1239-1247 (2014).
26. J. Childers, S. Snyder, S. Kohin, Migration and behavior of juvenile North Pacific albacore (Thunnus alalunga). Fish. Oceanogr. 20, 157–173 (2011).
27. N. C. Wegner, C. A. Sepulveda, K. B. Bull, J. B. Graham, Gill morphometrics in relation to gas transfer and ram ventilation in high-energy demand teleosts: Scombrids and billfishes. J. Morphol. 271, 36-49 (2010).
28. N. C. Wegner, C. A. Sepulveda, K. R. Olson, K. A. Hyndman, J. B. Graham, Functional morphology of the gills of the shortfin mako, Isurus oxyrinchus, a lamnid shark. J. Morphol. 271, 937-948 (2010).
29. N. C. Wegner, in Encyclopedia of Fish Physiology: From Genome to Environment, A. P. Farrell, E. D. Stevens, J. J. Cech, J. G. Richards, Eds. (Academic Press, San Diego, 2011), vol. 2, pp. 803-811.
30. D. Bernal, C. Sepulveda, O. Mathieu-Costello, J. B. Graham, Comparative studies of high performance swimming in sharks I. Red muscle morphometrics, vascularization and ultrastructure. J. Exp. Biol. 206, 2831-2843 (2003).
31. P. A. Hasgall, E. Neufeld, M. C. Gosselin, A. Klingenböck, N. Kuster, “IT’IS database for thermal and electromagnetic parameters of biological tissues,” Version 2.5. www.itis.ethz.ch/database (08-2014).
32. J. B. Graham, F. J. Koehrn, K. A. Dickson, Distribution and relative proportions of red muscle in scombrid fishes: consequences of body size and relationships to locomotion and endothermy. Can. J. Zool. 61, 2087-2096 (1983).
33. R. W. Brill, P. G. Bushnell, in Tuna: Physiology, Ecology and Evolution, B. A. Block, E. D. Stevens, Eds. (Academic Press, San Diego, 2001), vol. 19, pp. 79-120.
34. B. S. Muir, G. M. Hughes, Gill dimensions for three species of tunny. J. Exp. Biol. 51, 271-285 (1969).
35. S. H. Emery, Hematological comparisons of endothermic vs. ectothermic elasmobranch fishes. Copeia 1986, 700-705 (1986).
36. N. C. Lai et al., Hemodynamics and blood properties of the shortfin mako shark (Isurus oxyrinchus). Copeia 1997, 424-428 (1997).
37. D. Bernal et al., Comparative studies of high performance swimming in sharks II. Metabolic biochemistry of locomotor and myocardial muscle in endothermic and ectothermic sharks. J. Exp. Biol. 206, 2845-2857 (2003).
38. S. H. Emery, A. Szczepanski, Gill dimensions in pelagic elasmobranch fishes. Biol. Bull. 171, 441-449 (1986).
