Вільний доповнений переказ статті Elizabeth Pennisi у журналі Science на основі Kalluraya et al. 2023
Бактерії вільно обмінюються генетичною інформацією з іншими бактеріями у ході так званого горизонтального переносу генів:
Бактерії також отримують нові гени від вірусів.
Багатоклітинні організми, включаючи нас, теж мають багато вірусної ДНК. Близько 10% нашої ДНК наші пращури колись отримали не від власних батьків, а внаслідок інфікування вірусами, і тепер ці шматочки, переважно у вигляді напівзруйнованого генетичного баласту, назавжди лишаються з нами як нагадування про битви, з яких наші предки вийшли переможцями, хоч і зміненими назавжди, як фрагменти наконечника стріли у коліні. А іноді ми навіть використовуємо ці шматочки собі на користь.
Але ми не бактерії, і від бактерій ми спадковість не отримували, правда? Виявляється, не зовсім. Людський геном містить близько 200 генів, успадкованих нами від бактеріальних ворогів, яких ми зустрічали на еволюційному шляху, уже будучи хребетними. Ми це знаємо завдяки кропіткому порівнянню цих генів з іншими видами. Потрібно лише пошукати, які гени “різко” з'явилися у хребетних і при цьому мають підозрілу подібність до генів у нині існуючих бактеріях.
Одним з таких генів виявився IRBP (interphotoreceptor retinoid-binding protein, інтерфоторецепторний ретиноїд-зв'язуючий протеїн), критичний для нашого зору. Цей білок у нас повертає вітамін А із використаного паличками і колбочками стану транс-ретинолу на “відновлення” у пігментний епітелій сітківки. Після відновлення до робочого стану 11-цис-ретиналю, IRBP повертає його у світлочутливі рецептори:
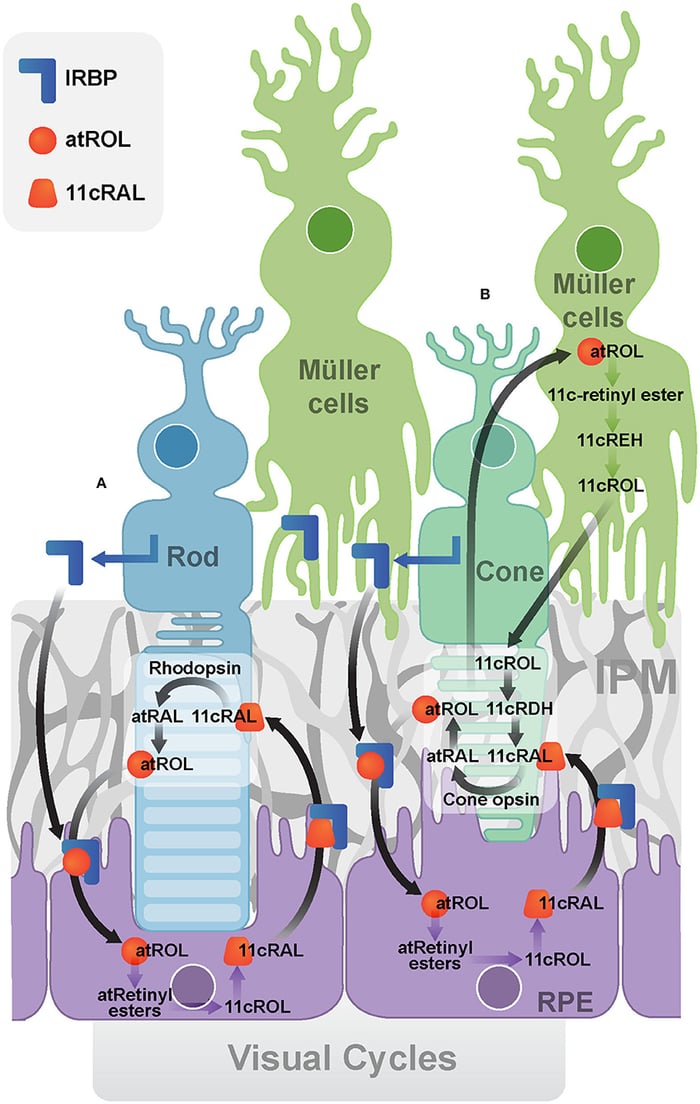
Ну тобто якщо колбочки ще щось можуть без IRBP завдяки клітинам Мюллера, то палички повністю безпорадні.
Ми буквально володіємо суперсилою - у десятки тисяч разів підвищувати свою чутливість до світла, тому що за десятки хвилин у відповідь на потемніння середовища починаємо виробляти дуже велику кількість світлочутливих пігментів родопсину і йодопсину. За дефіциту вітаміну А в першу чергу страждає нічний зір (“куряча сліпота”), який потребує різкого збільшення вітаміну А, щоб обслуговувати збільшені кількості пігментів, а якщо його мало у їжі, то йому нізвідки взятися, і наша суперсила зникає.
Так от, ген, що кодує IRBP, за своєю послідовністю підозріло нагадує гени, що кодують у бактерій пептидази - білки, що рециклюють інші білки. У наших найближчих нехребетних родичів гена IRBP немає, а у всіх хребетних - є. Якщо що, найближчі нехребетні родичі - це ось:

Daugherty зробив припущення, що спільний предок усіх хребетних близько 500 млн років тому отримав від бактерії її ген пептидази. Він швидко втратив свою оригінальну функцію, а потім ще й пройшов 2 дуплікації у нашому геномі (взагалі дуже корисній події у нашій еволюції, можливо, без неї ми б ніколи не могли стати такими розумними), тому у сучасних хребетних аж 4 копії цієї пептидази. Доречі, цілком можливо, що світлочутливі сполуки ця пептидаза могла чіпляти ще у бактерій. Потім ген пройшов ще кілька мутацій, що дали змогу нашому варіанту пептидази вільно плавати у міжклітинному просторі і робити свою роботу для нас.
Утім, як зазначає дослідник зору безхребетних тварин Sönke Johnsen, безхребетні обходяться і без IRBP. У них вітамін А не мігрує туди-сюди між світлочутливими клітинами і епітелієм, а лишається на перших. Його згинають у транс- одні хвилі світла і розгинають у цис-форму інші. Взагалі “підходи” різних безхребетних тварин до зору дуже розмаїті і включають дуже хороші, так би мовити, варіанти дизайну. Тому не IRBP єдиним. Але зір хребетних, здається, так і залишиться IRBP-центрованим, так би мовити. Якщо чесно, мені подобається мій зір, а вам?
Насправді ж, ця історія не про зір, не про специфічний білок для зору, а про те, що ми всі ГМО. Ми всі назавжди змінені навіть тими битвами, які успішно перемогли. І ми носимо у кожній клітині (еритроцити не рахуємо ;)) не генетичні уламки наших ворогів, а потенційний матеріал для апсайклінгу - перетворення мотлоху на щось нове і корисне.
Дякую за увагу і бажаю сил переробити свої наслідки битв на щось, із чим можна жити далі, а може навіть пишатися❤️
