Проблема згортання білків десятиліттями залишалася однією з найскладніших у біології: як із послідовності амінокислот передбачити тривимірну структуру, що визначає функцію білка? AlphaFold від DeepMind не лише дав відповідь, а й переписав правила наукових досліджень, отримавши за це Нобелівську премію з хімії 2024 року. Ця стаття досліджує наукові основи, історичний контекст, шлях команди, технічні деталі, вплив на медицину та майбутні перспективи цього прориву.
Проблема згортання білків
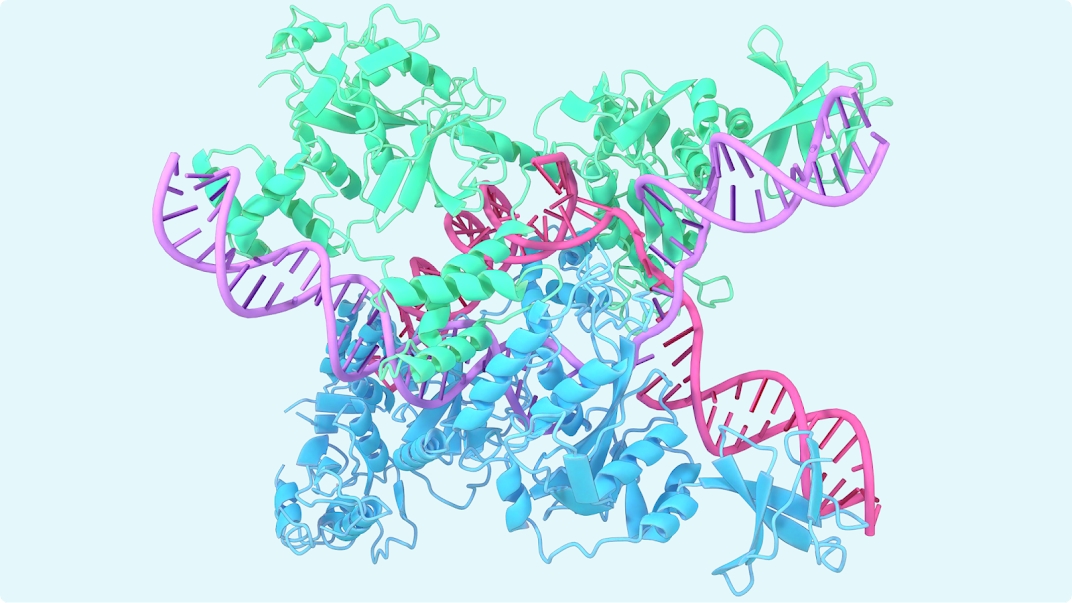
Білки — це молекулярні "машини" життя, які виконують безліч функцій: ензими каталізують реакції, антитіла захищають від інфекцій, колаген підтримує тканини. Їхня тривимірна структура, що формується з послідовності амінокислот, є ключем до їхньої роботи. Структура має чотири рівні: первинна (ланцюжок амінокислот), вторинна (спіралі та листи, стабілізовані водневими зв’язками), третинна (повна 3D-форма одного ланцюга, зумовлена гідрофобними й електростатичними взаємодіями) і четвертинна (комплекс кількох ланцюгів, як у гемоглобіні). У природі білок згортається за секунди, але передбачити це теоретично — надзвичайно складно.
Чому це так важко? Для білка з 100 амінокислот кількість можливих конформацій перевищує число атомів у Всесвіті (10^300). У 1972 році Крістіан Анфінсен довів, що структура закодована в послідовності: розгорнутий білок повертається до своєї форми сам. Але як це змоделювати? Фізичні сили — гідрофобні ефекти, водневі зв’язки, Ван-дер-Ваальсові взаємодії — діють одночасно, створюючи "лабіринт" можливостей. Розуміння структури має величезне значення: наприклад, при хворобі Альцгеймера амілоїд-бета згортається неправильно, утворюючи токсичні агрегати, а в розробці ліків знання структури дозволяє створювати молекули, що точно "чіпляються" до білків-мішеней.
Від експериментів до комп’ютерів
До комп’ютерної ери структури визначали експериментально. У 1930-х Лайнус Полінг припустив, що водневі зв’язки формують спіралі та листи — перше розуміння вторинної структури. У 1950-х рентгенівська кристалографія стала проривом: Джон Кендрю й Макс Перутц розшифрували міоглобін і гемоглобін, аналізуючи розсіювання променів кристалами. Але підготовка кристалів могла тривати роки. У 1970-х ядерний магнітний резонанс (ЯМР) дозволив "бачити" малі білки в розчині, але не великі чи мембранні. У 1990-х кріоелектронна мікроскопія (кріо-ЕМ) "заморожувала" молекули, даючи змогу вивчати їх у природному стані, але не завжди з високою роздільною здатністю. Ці методи розшифрували ~170 000 структур із мільярдів відомих послідовностей — повільно, дорого й вибірково.
Комп’ютерні методи з’явилися як надія. Молекулярна динаміка симулювала рух атомів, але навіть суперкомп’ютери не справлялися з обсягами обчислень. Гомологічне моделювання порівнювало послідовності з відомими структурами, але для нових білків було неефективним. Точність залишалася низькою — до 40% у найкращих випадках.
CASP: Змагання, що стало мірилом
У 1994 році стартував Critical Assessment of protein Structure Prediction (CASP) — б’єніальний конкурс, де вчені тестували алгоритми на неопублікованих структурах. CASP став "грою" для оцінки прогресу. Протягом двох десятиліть результати покращувалися повільно: моделі досягали 40-50 GDT (Global Distance Test, шкала точності 0-100), спираючись на гомологію. Для нових білків без аналогів прогнози були слабкими, що підкреслювало потребу в радикальних інноваціях.
DeepMind і AlphaFold: Команда, що змінила гру
DeepMind, заснований у 2010 році Демісом Хассабісом — нейробіологом і ексрозробником ігор, — прославився завдяки AlphaGo, який у 2016 році переміг чемпіона Го. Хассабіс бачив ШІ як інструмент для науки, а згортання білків — як "гру" з високими ставками. У 2016 році, після успіху AlphaGo, він зібрав команду для AlphaFold: Джон Джампер (біолог, експерт з еволюції білків), Кетрін Туньясук (програмістка, спеціалістка з нейронних мереж), математики типу Річарда Еванса та десятки інших. Їхній підхід був гейміфікованим: якщо ШІ може "навчитися" стратегії в Го, чому не в біології?
AlphaFold 1 (2018): На CASP13 команда дебютувала з моделлю, що використовувала глибоке навчання. Аналіз множинних вирівнювань послідовностей (MSA) показував еволюційні зв’язки, а нейронні мережі передбачали відстані й кути між амінокислотами. Результат: GDT ~68,5 — перемога, але далека від атомної точності (~90 GDT). Робота кипіла в лондонському офісі: ночі за кодом, тести на суперкомп’ютерах, дебати про алгоритми. "Це був лише початок", — згадував Джампер.
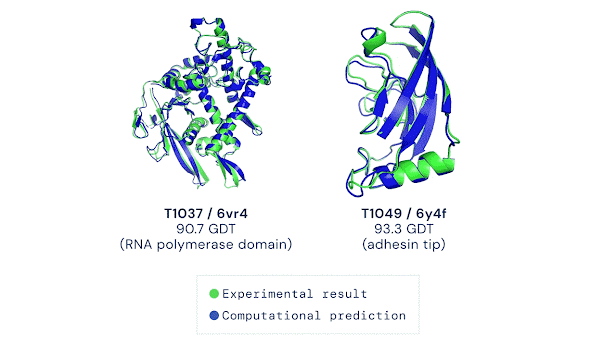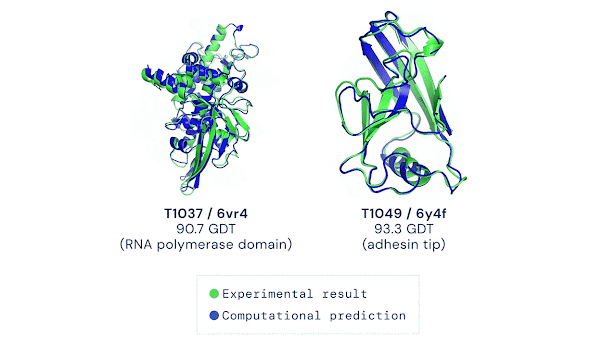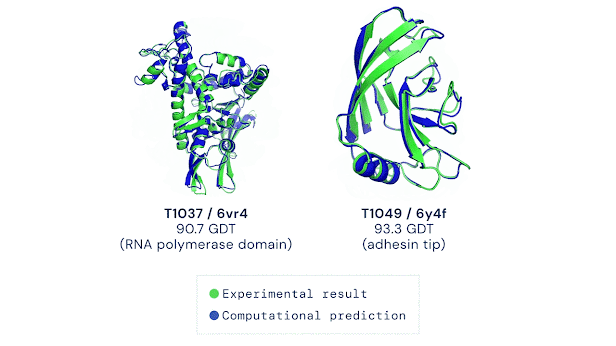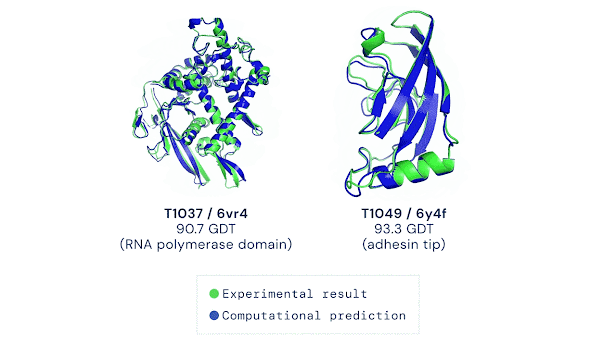
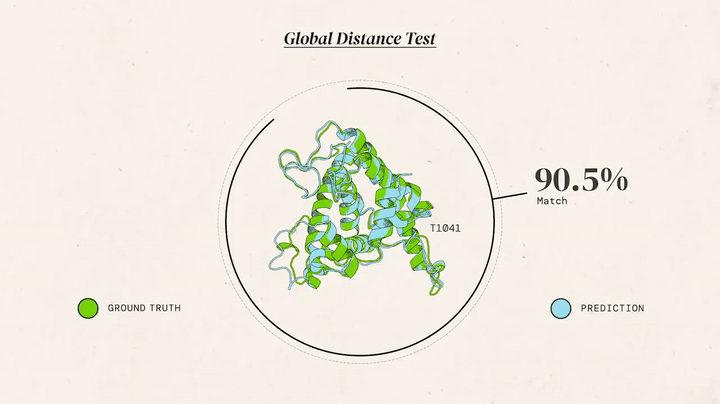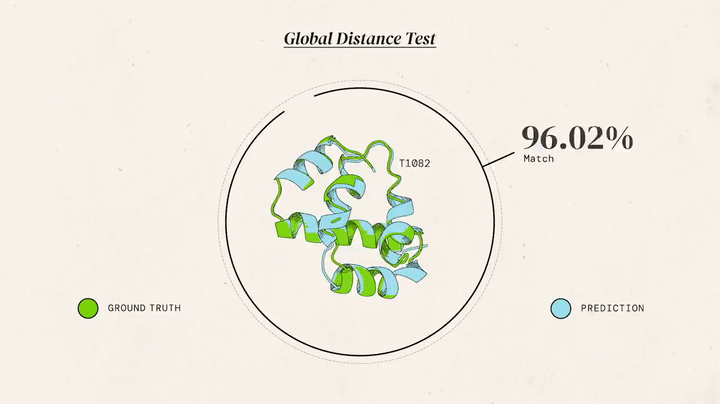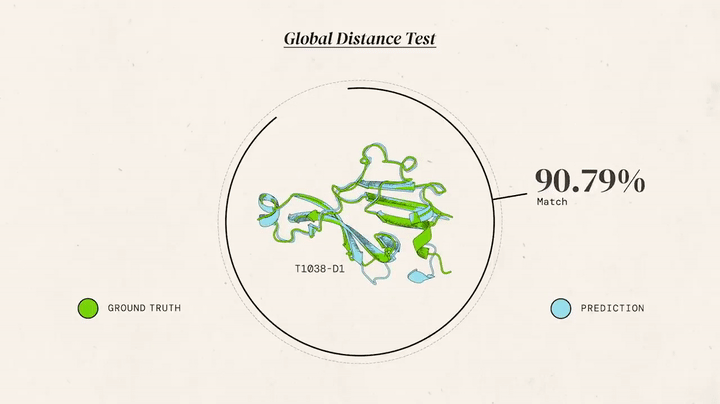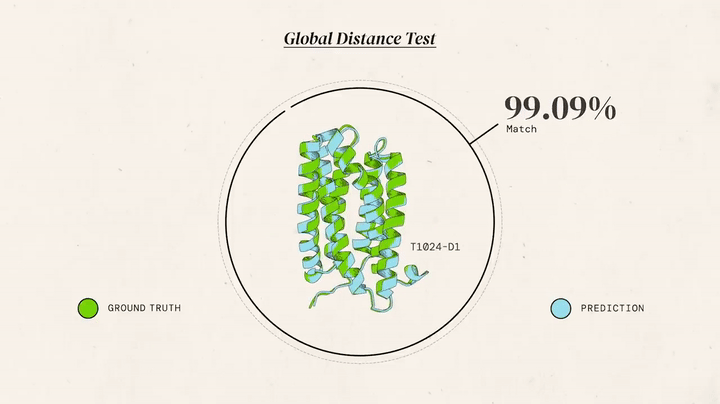
AlphaFold 2 (2020): До CASP14 команда переосмислила підхід. AlphaFold 2 отримав модуль Evoformer із двома "баштами": одна аналізувала еволюційні дані, друга — геометрію, обмінюючись інформацією 48 разів. Структурний модуль будував 3D-форму з похибкою 1,6 ангстрема (розмір атома). Ключові інновації: механізми уваги (як у мовних моделях) для "бачення" зв’язків між далекими амінокислотами, наскрізне навчання (від послідовності до структури) і ітеративне уточнення. Результат: GDT 92,4, для нових білків — 87 GDT. "Ми розв’язали проблему", — заявив Хассабіс.
Процес був інтенсивним: команда тренувала модель на 170 000 структур із Protein Data Bank, використовуючи TPU (процесори Google). Щоденні брейншторми нагадували розробку гри: біологи вказували на гідрофобні ефекти чи водневі зв’язки, програмісти втілювали це в коді, ШІ "грав" проти природи, вдосконалюючись із кожною ітерацією.
Як працює AlphaFold?
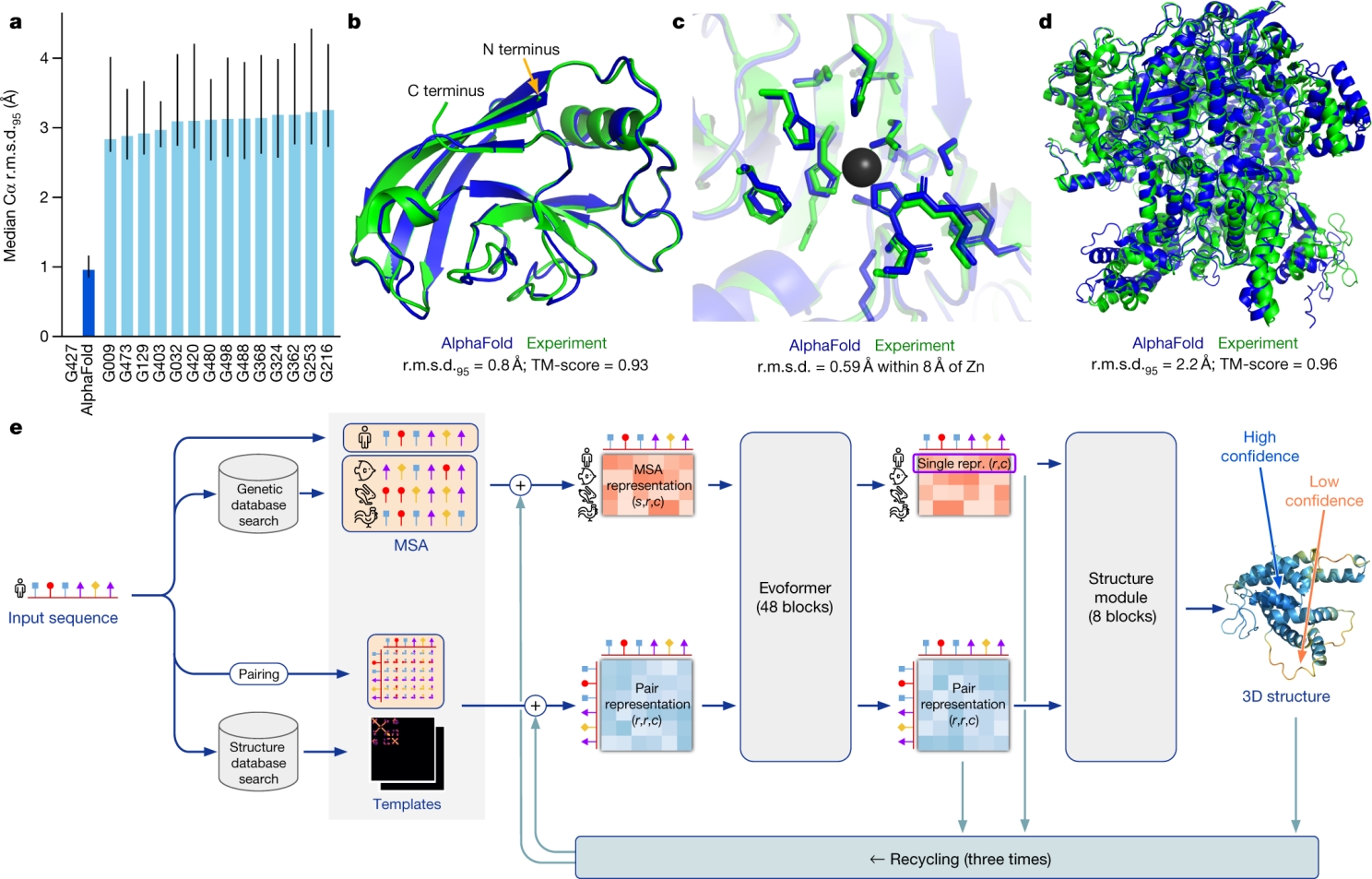
AlphaFold від DeepMind — це ШІ, який "бачить" тривимірну структуру білків, ніби розв’язуючи пазл, як показано на схемі. Спочатку ви даєте йому послідовність амінокислот — наприклад, "MKTAYIAKQR". ШІ бере цю "нитку" і шукає в базах даних (генетична база, Structural database) схожі послідовності з інших організмів, щоб зрозуміти, які амінокислоти часто "дружать" у природі — це називається множинне вирівнювання послідовностей (MSA). Потім він порівнює пари амінокислот (Pairing), щоб "здогадатися", хто з ким може бути поруч у 3D-формі. Далі вступає модуль Evoformer — це як "мозок" ШІ, що складається з 48 блоків. Кожен блок — це ніби маленький "детектив", який дивиться на два типи даних: еволюційні зв’язки (MSA-представлення) і просторові відстані між амінокислотами (Pair representation). ШІ "розмовляє" сам із собою, обмінюючись інформацією між цими двома "баштами", щоб зрозуміти, наприклад, що амінокислота на початку ланцюжка може бути близько до тієї, що в кінці, коли білок згорнеться. Для цього він використовує механізми уваги — це як "фокус" у голові ШІ, який допомагає звертати увагу на найважливіші зв’язки, навіть якщо вони далеко в послідовності. Після цього Структурний модуль бере ці "здогадки" і малює 3D-модель, ніби складаючи орігамі: він пробує різні форми, уточнює їх кілька разів (ітеративно), доки не вийде точна структура з похибкою лише 1,6 ангстрема (розмір атома). Усе це ШІ робить за години, хоча в лабораторії це могло б тривати роки.
AlphaFold 2 — це шедевр ШІ. Evoformer аналізує еволюційні закономірності (наприклад, які амінокислоти часто "сусідять") і передає дані в структурний модуль, який будує 3D-модель. Механізми уваги дозволяють "зосередитися" на ключових взаємодіях, а ітеративність — уточнювати прогнози, ніби ШІ "переграє" рівень. Точність досягає 92,4 GDT для відомих білків і 87 GDT для нових, що конкурує з рентгенографією (1-2 ангстрема). Для порівняння, молекулярна динаміка давала ~50 GDT і вимагала місяців обчислень, тоді як AlphaFold справляється за години.
Edit image
Delete image
Вплив на науку і медицину
AlphaFold 2 трансформував біологію. У розробці ліків він прискорив дизайн молекул: наприклад, допоміг створити вакцину проти малярії, розкривши структуру ключового білка Plasmodium. Він пояснює хвороби: мутації при раку чи шизофренії тепер можна "побачити" в 3D. За даними Nature, AlphaFold цитувався понад 30 000 разів, а в 2021 році DeepMind випустив базу з 200+ мільйонами структур, доступну через EMBL-EBI. Це дало змогу синтезувати білки для антидотів чи ферменти.
У 2023 році Хассабіс і Джампер отримали Lasker Award, а в 2024-му — Нобелівську премію з хімії разом із Девідом Бейкером за "революцію в передбаченні структур". Нобелівський комітет відзначив, що AlphaFold "змінив наше розуміння життя на молекулярному рівні".

Спробувати самим?
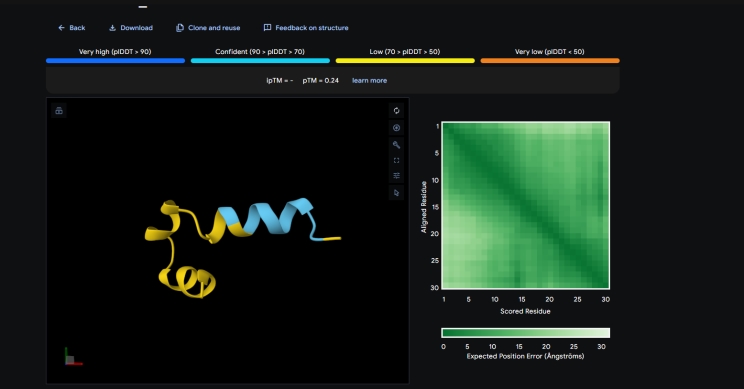
AlphaFold 3, найновіший ШІ від DeepMind, який у 2024 році розкрив структури білків із фантастичною точністю. Цей інструмент доступний кожному через AlphaFold Server (https://alphafoldserver.com/) — безкоштовно, онлайн, без складного обладнання. Хочете розгадати, як працює білок у вашому улюбленому організмі чи навіть допомогти науці? Ось як це зробити — просто, швидко й захопливо.
Крок 1: Зайдіть на https://alphafoldserver.com/ і увійдіть через Google-акаунт — це ваш пропуск у світ молекул. Укажіть мету (наприклад, "досліджую для себе" чи "навчаюся"), і за мить ви в грі. Жодних складних форм — усе інтуїтивно, як у вашому улюбленому додатку.
Крок 2: У полі введення киньте послідовність амінокислот у форматі FASTA — наприклад, "MKTAYIAKQR" для білка чи "ATCG" для ДНК. Хочете більше? Додайте РНК або молекулу (наприклад, кофеїн у форматі SMILES: "CN1C=NC2=C1C(=O)N(C(=O)N2C)C"). Не знаєте, що обрати? Візьміть код із UniProt, як "P00533" (рецептор EGFR), і досліджуйте білок, пов’язаний із раком. AlphaFold 3 "з’їсть" до 4000 амінокислот — це ваш молекулярний холст!
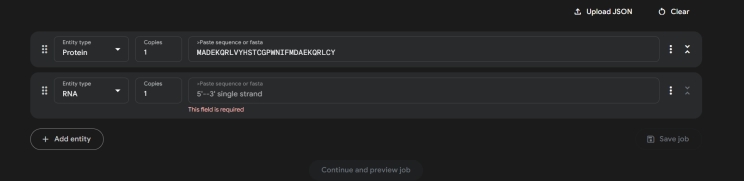
Крок 3: Оберіть режим: "швидкий" — і за 10-15 хвилин маєте модель, або "глибокий" — до 30 хвилин із деталями, гідними Нобеля. Додайте ліганди чи РНК, якщо мрієте побачити, як молекули "танцюють" разом. Інтерфейс простий, а відчуття — ніби ви запускаєте космічний корабель у світ атомів.
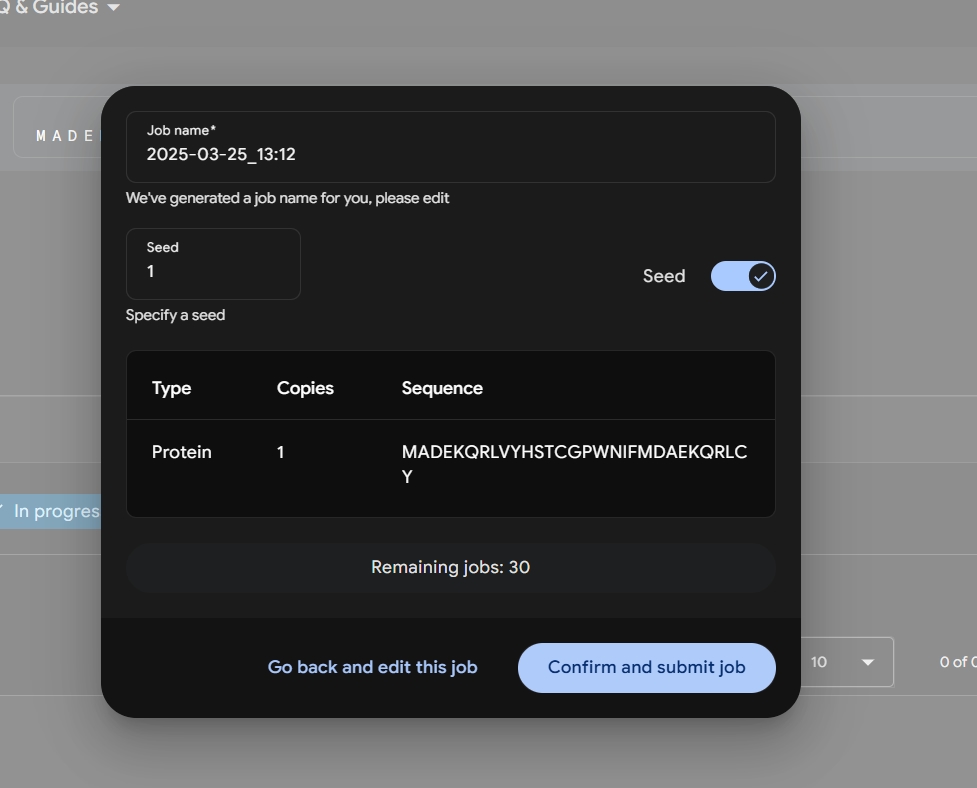
Крок 4: Отримайте свій шедевр Натисніть "Predict" і зачекайте — за мить ШІ намалює 3D-модель у форматі PDB. Відкрийте її в PyMOL чи Chimera, щоб покрутити, наблизити, відчути себе вченим. Показник pLDDT (0-100) підкаже, де модель точна (90+ — просто вау!). А GDT порівняє її з реальністю. Завантажте файл або милуйтеся онлайн — це ваш квиток у мікросвіт.